Energi
ikatan didefinisikan sebagai sejumlah energi yang dibutuhkan untuk
memutuskan satu mol ikatan suatu spesi dalam keadaan gas. Energi akan
dilepas bila atom-atom bergabung bersama-sama membentuk suatu ikatan
kimia. Dengan kata lain reaksi pembentukan suatu senyawa selalu
berlangsung eksoterm sedangkan reaksi penguraian sengawa menjadi
unsur-unsurnya berlangsung secara endoterm.
Satuan SI (standar internasional) energi ikatan adalah kilojoule permol ikatan (kJ/mol).
Dengan demikian kekuatan suatu ikatan kimia ditentukan oleh energi
ikatan yang besarnya bergantung pada sifat ikatan antara atom-atom yaitu
: ikatan ganda tiga lebih kuat ikatan rangkap dua dan ikatan rangkap
dua lebih kuat ikatan tunggal. Jarak ikatan atau panjang ikatan ganda
tiga lebih pendek dibanding ikatan ganda dua dan lebih pendek dibanding
tunggal. Semakin pendek suatu ikatan kimia, maka ikatan tersebut semakin
kuat. Jadi kekuatan ikatan kimia mulai dari terkuat ke yang paling
lemah adalah ikatan ganda tiga > ikatan rangkap 2 > ikatan
tunggal.
Walaupun
demikian perlu diperhatikan bahwa ikatan ion lebih kuat dari ikatan
kovalen kecuali intan dan beberapa senyawa kovalen lain. Intan walaupun
memiliki ikatan kovalen namun ikatannya sangat kuat. Hal ini dapat
dilihat dari titik didih dan titih lelehnya yang sangat tinggi. Ikatan
ion dan kovalen disebut ikatan primer, sedangkan ikatan van der waals,
ikatan hidrogen termasuk ikatan sekunder. ikatan primer lebih kuat
dibanding ikatan sekunder.
Energi
ikatan dalam molekul diatomik tidak sulit dipahami karena hanya
terdapat satu ikatan permolekul. Namun pada molekul poliatomik seperti H2O
keadaannya berbeda. Energi yang diperlukan untuk memisahkan satu mol
atom H dengan pemecahan satu ikatan H-OH permolekul berbeda dengan
energi yang diperlukan untuk memisahkan mol kedua dari atom H dari
pemecahan ikatan OH.
H-OH(g) → H(g) + OH(g) ΔH = +492 kJ/mol
OH(g) → H(g) + O(g) ΔH = +428 kJ/mol
Hal
ini terjadi karena energi ikatan tergantung pada pada lingkungan yaitu
bagian dari molekul yang berdekatan dengan ikatan, biasanya digunakan
nilai rata-rata. Kebanyakan
molekul energi ikatan rata-rata bersifat aditif yaitu jumlah seluruh
energi ikatan merupakan penjumlahan dari energi masing-masing ikatan.
Secara spektroskopi dapat digunakan untuk menentukan jarak ikatan dan
beberapa energi ikatan. Energi ikatan lainnya dapat ditentukan secara
tidak langsung melalui hukum Hess dan data seperti kalor pembentukan dan
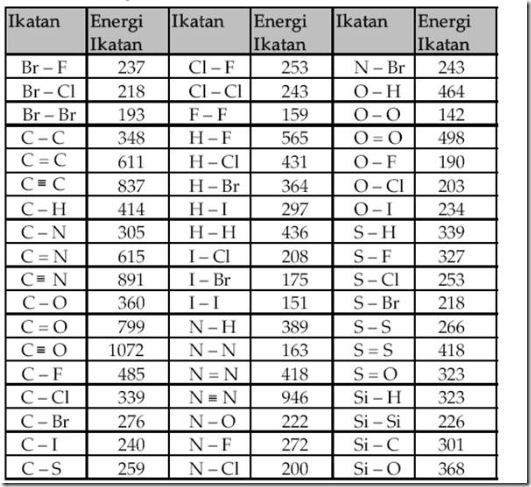
kalor pembakaran. Energi ikatan dalam kJ/mol beberapa ikatan sebagai berikut.
PERHITUNGAN YANG MELIBATKAN ENERGI IKATAN
Reaksi-reaksi
yang melibatkan fasa gas dapat diguankan suatu hipotesis yakni semua
ikatan dalam dalam pereaksi diputuskan dan kemudian dibentuk lagi pada
hasil reaksi. Jumlah perubahan energi pemutusan ikatan dan pembentukan
ikatan menghasilkan perubahan entalpi reaksi (ΔHreaksi).
Contoh Soal
Hitunglah perubahan entalpi reaksi (ΔHreaksi) untuk reaksi
CH4(g) + 4Cl2(g) → CCl4(g) + 4HCl(g)
Penyelesaian
ΔH pemutusan ikatan
4 mol ikatan C-H = 4 x (+414 kJ/mol) = 1656 kJ
4 mol ikatan Cl-Cl = 4 x (+243 kJ/mol)= +972 kJ
ΔH pembentukan ikatan
4 mol ikatan C-Cl = 4 mol x (-326 kJ/mol)=-1304 kJ
4 mol ikatan H-Cl = 4 mol x (-431 kJ/mol) = -1724 kJ
Maka entalpi reaksi (ΔHreaksi)
ΔHreaksi = ΔHpemutusan ikatan + ΔHpembentukan ikatan
= +1656 kJ + 972 kJ – 1304 kJ – 1724 kJ = -400 kJ
KALOR BAHAN BAKAR
Mengukur
entalpi reaksi sama saja dengan mengukur kalor yang dilepaskan atau
kalor pembakaran. Oleh sebab itu cara menghitung entalpi reaksi dapat
digunakan untuk membandingkan dua atau lebih bahan bakar apa yang paling
efektif dan efisien. Untuk mengetahui jenis bahan bakar yang efektif
dan efisien sesuai kebutuhan, dapat dilakukan pengujian dengan cara
membakar bahan bakar. Kalor yang dilepaskan dipakai memanaskan air dan
kalor yang diserap oleh air dihitung.
Efektivitas
bahan bakar dapat dibandingkan berdasarkan jumlah kalor dengan volume
yang sama. Pada volume yang sama, semakin besar jumlah kalor yang
dilepaskan, semakin efektif bahan bakar tersebut untuk digunakan sesuai
kebutuhan. Efisiensi bahan bakar dapat dibandingkan berdasarkan jumlah
volume dan harga. Untuk volume yang sama, semakin murah harga BBM,
semakin efisien BBM tersebut untuk digunakan sesuai kebutuhan. Namun,
ada beberapa aspek yang perlu diperhatikan berkaitan dengan penggunaan
BBM. Aspek tersebut di antaranya keamanan dan kebersihan lingkungan.
Bensin
tidak dapat digunakan untuk kebutuhan di rumah sebab bensin mudah
menguap sehingga mudah terbakar, yang berdampak pada risiko keamanan.
Minyak tanah tidak dapat digunakan untuk kendaraan bermotor sebab sukar
terbakar dan bersifat korosif. Akibatnya, jika minyak tanah dipakai
untuk kendaraan, mesin sukar dihidupkan dan cepat rusak. Di samping itu,
akibat dari sukar terbakar dapat menimbulkan asap yang tebal dan
berdampak pada pencemaran lingkungan.
No comments:
Post a Comment