Pendahuluan
Dalam kehidupan sehari-hari kita sering bersinggungan dengan sistem koloid sehingga sangat penting untuk dikaji. Sebagai contoh, hampir semua bahan pangan mengandung partikel dengan ukuran koloid, seperti protein, karbohidrat, dan lemak. Emulsi seperti susu juga termasuk koloid. Dalam bidang farmasi, kebanyakan produknya juga berupa koloid, misalnya krim, dan salep yang termasuk emulsi. Dalam industri cat, semen, dan industri karet untuk membuat ban semuanya melibatkan sistem koloid. Semua bentuk seperti spray untuk serangga, cat, hair spray, dan sebagainya adalah juga koloid. Dalam bidang pertanian, tanah juga dapat digolongkan sebagai koloid. Jadi sistem koloid sangat berguna bagi kehidupan manusia.
Pengertian
Koloid adalah suatu bentuk campuran yang keadaannya antara larutan dan suspensi. Larutan memiliki sifat homogen dan stabil. Suspensi memiliki sifat heterogen dan labil. Sedangkan koloid memiliki sifat heterogen dan stabil.
Perhatikan perbedaan tiga contoh campuran di bawah ini:
· Campuran antara air dengan sirup
· Campuran antara air dengan susu.
· Campuran antara air dengan pasir.
Jika kita campurkan air dengan sirup maka sirup akan terdispersi (bercampur) dengan air secara homogen (bening) Jika didiamkan, campuran itu tidak memisah dan juga tidak dapat dipisahkan dengan penyaringan biasa maupun penyaringan yang lembut (penyaringan mikro). Secara makroskopis maupun mikroskopis mcampuran ini tampak homogen, tidak dapat dibedakan mana yang air dan mana yang sirup. Campuran seperti inilah yang disebut larutan.
Jika kita campurkan susu (misalnya, susu instan) dengan air, ternyata susu “larut” tetapi “larutan” itu tidak bening melainkan keruh. Jika didiamkan, campuran itu tidak memisah dan juga tidak dapat dipisahkan dengan penyaringan (hasil penyaringan tetap keruh). Secara makroskopis campuran ini tampak homogen. Akan tetapi, jika diamati dengan mikroskop ultra ternyata masih dapat dibedakan partikel-partikel lemak susu yang tersebar di dalam air. Campuran seperti inilah yang disebut koloid.
Jika kita campurkan air dengan pasir maka pasir akan terdispersi (bercampur) dengan air secara heterogen dan langsung memisah antara air dengan pasir, yang keadaannya pasir akan mengendap di dasar air dan dapat dipisahkan dengan penyaringan biasa, bahkan dapat dipisahkan dengan cara dituang perlahan-lahan. Secara makroskopis campuran ini sudah tampak hetrogen, dapat dibedakan mana yang air dan mana yang pasir. Campuran seperti inilah yang disebut suspensi.
Secara ringkas perbandingan sifat larutan, koloid dan suspensi seperti yang pada Tabel beikut.
|
Sifat |
Larutan |
Koloid |
Suspensi |
|
Ukuran |
1 nm |
1-100 nm |
> 100 nm |
|
Pengyaringan |
Filter/membran |
Filter |
Tidak dengan filter atau membran |
|
Jarak penglihatan tampak |
Tidak nampak |
Tampak dengan mikroskop elektron |
Tampak dengan mikroskop cahaya |
|
Gerakan |
Molekul |
Brown |
Gya berat |
|
Lintasan cahaya |
Transparan |
Kadang tembus cahaya/buram |
Sering kali buram mungkin tembus cahaya |
|
Efek tyndall |
Tidak ada |
Ada |
|
|
Jumlah fasa |
satu |
dua |
dua |
Contoh: tepung kanji dimasukkan ke dalam air panas maka akan membentuk sistem dispersi. Di sini air sebagai medium pendispersi, dan tepung kanji sebagai zat terdispersi.
Jadi, koloid tergolong campuran heterogen (dua fase) dan setabil. Zat yang didipersikan disebut fase terdispersi, sedangkan medium yang digunakan untuk mendispersikan zat disebut medium dispersi. Fase terdispersi bersifat diskontinu (terputus-putus), sedangkan medium dispersi bersifat kontinu. Pada campuran susu dengan air, fase terdispersi adalah lemak, sedangkan medium dispersinya adalah air.
JENIS-JENIS KOLOID
Jenis-jenis sistem koloid berdasarkan jenis fasa terdispersi dan medium dispersi seperti yang tertera pada Tabel di bawah ini.
|
No. |
Zat terdispersi |
Medium dispersi |
Nama Tipe |
Contoh |
|
1. |
Gas |
Cairan |
Busa |
Krim kocok, busa bir, busa sabun |
|
2. |
Gas |
Padat |
Busa padat |
Batu apung, karet busa |
|
3. |
Cairan |
Gas |
Aerosol cair |
Kabut, awan |
|
4. |
Cairan |
Cairan |
Emulsi |
Mayones, susu |
|
5. |
Cairan |
Padat |
Emulsi padat |
Keju, mentega |
|
6. |
Padat |
Gas |
Aerosol |
Asap, debu di udara |
|
7. |
Padat |
Cair |
Sol gel |
Pati dalam air, selai Agar-agar dingin |
|
8. |
Padat |
Padat |
Sol padat |
Intan hitam, kaca rubi |
Dari tabel di atas dapat diketahui bahwa tidak ada koloid yang terbentuk dari campuran antara gas-gas. Hal ini disebabkan campuran gas-gas tercampur secara merata sehingga disebut juga sebagai larutan.
Aeresol
Aerosol ada yang berupa aerosol cair dan aerosol padat. Aerosol cair merupakan koloid yang fase terdispersinya zat cair dan medium pendispersinya gas. Contoh aerosol cair hasil industri adalah pembasmi serangga dalam bentuk spray, hair spray, dan parfum. Jika disemprotkan di udara, titik-titik zat cair akan tersebar di udara membentuk koloid aerosol. Aerosol cair yang terjadi secara alami
Contohnya kabut dan awan.
Kabut merupakan titik-titik yang tersebar di udara secara merata. Aerosol padat merupakan koloid yang fase terdispersinya zat padat dan medium pendispersinya gas. Aerosol padat contohnya asap dan debu. Berbagai asap sebenarnya berupa partikelpartikel padat sangat halus yang tersebar di udara. Asap berbahaya yang terjadi di rumah atau di ruangan adalah asap obat nyamuk dan asap rokok yang berlebihan. Debu juga merupakan partikel-partikel padat sangat halus, yang tersebar di udara. Debu dapat berada di rumah karena terbawa angin dari luar.
Busa
Busa ada yang berupa buih dan busa padat. Buih atau busa cair merupakan koloid yang fase terdispersinya gas dan medium pendispersinya zat cair. Buih yang paling banyak ditemukan yaitu busa sabun. Contoh lainnya yaitu putih telur yang dikocok. Udara sebagai fase terdispersi dan putih telur sebagai medium pendispersi.
Di bidang industri kosmetik ada bahan untuk pengeras rambut yang berupa busa cair atau foam. Sedangkan di industri makanan contoh bahan berupa busa cair yaitu krem untuk kue tart. Krem ini dikemas dalam tube seperti pasta gigi.
Busa padat, fase terdispersinya gas, medium pendispersinya zat padat. Produk busa padat yang banyak digunakan untuk kemasan barang yang mudah pecah atau rusak adalah styrofoam. Styrofoam salah satu contoh dari polimer sintetis.
Emulsi
Emulsi merupakan koloid yang fase terdispersinya dan medium pendispersinya zat cair, contohnya campuran minyak dan air. Campuran ini cenderung untuk terpisah sehingga untuk menstabilkan campuran biasanya ditambahkan emulgator.
Bahan yang merupakan emulsi misalnya cat, pasta gigi, kosmetik (cleansing milk, foundation), dan salad dressings. Padasalad dressings untuk menyatukan minyak dan air digunakan emulgator kuning telur. Sabun juga merupakan emulgator untuk menyatukan lemak/minyak pada tubuh dengan air saat membersihkan badan. Emulsi padat fase terdispersinya zat cair, medium pendispersinya zat padat. Contoh mentega, keju, dan jelli.
SIFAT-SIFAT KOLOID
Berikut beberapa topik yang akan di bahas mengenai sifat-sifat koloid.
a) Efek Tyndall
b) Gerak Brown
c) Muatan Koloid
d) Koagulasi
e) Koloid Pelindung
f) Koloid Liofil dan Koloid Liofob
a. Gerak brown
Gerka brown adalah gerak tidak beraturan atau gerak acak atau gerak zig-zag partikel koloid. Hal ini terjadi karena adanya benturan tidak teratur daari partikel koloid denga medium pendispersi. Dengan adanya gerak Brown ini maka partikel koloid terhindar dari pengendapan karena terus-menerus bergerak, sehingga koloid menjadi stabil. Gerak zig-zag partikel koloid disebut gerak Brown, sesuai dengan nama penemunya Robert Brown seorang ahli biologi berkebangsaan Inggris.

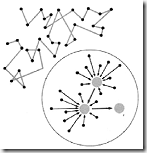
Gambar Robert Brown dan gerak brwon.
Jika kita amati koloid dibawah mikroskop ultra, maka kita akan melihat bahwa partikel-partikel tersebut akan bergerak membentuk zigzag. Pergerakan zigzag ini dinamakan gerak Brown. Partikel-partikel suatu zat senantiasa bergerak. Gerakan tersebut dapat bersifat acak seperti pada zat cair dan gas( dinamakan gerak brown), sedangkan pada zat padat hanya beroszillasi di tempat ( tidak termasuk gerak brown ).
Untuk koloid dengan medium pendispersi zat cair atau gas, pergerakan partikel-partikel akan menghasilkan tumbukan dengan partikel-partikel koloid itu sendiri. Tumbukan tersebut berlangsung dari segala arah. Oleh karena ukuran partikel cukup kecil, maka tumbukan yang terjadi cenderung tidak seimbang. Sehingga terdapat suatu resultan tumbukan yang menyebabkan perubahan arah gerak partikel sehingga terjadi gerak zigzag atau gerak Brown.
Semakin kecil ukuran partikel koloid, semakin cepat gerak Brown yang terjadi. Demikian pula, semakin besar ukuran partikel koloid, semakin lambat gerak Brown yang terjadi. Hal ini menjelaskan mengapa gerak Brown sulit diamati dalam larutan dan tidak ditemukan dalam campuran heterogen zat cair dengan zat padat (suspensi).
Gerak Brown juga dipengaruhi oleh suhu. Semakin tinggi suhu sistem koloid, maka semakin besar energi kinetik yang dimiliki partikel-partikel medium pendispersinya. Akibatnya, gerak Brown dari partikel-partikel fase terdispersinya semakin cepat. Demikian pula sebaliknya, semakin rendah suhu sistem koloid, maka gerak Brown semakin lambat.
b. Efek tyndall
Efek tindal yaitu efek penghamburan cahaya oleh partikel koloid. Efek tyndall ini ditemukan oleh John Tyndall (1820-1893), seorang ahli fisika Inggris. Oleh karena itu sifat itu disebut efek tyndall. Efek Tyndall adalah efek yang terjadi jika suatu larutan terkena sinar. Pada saat larutan sejati (gambar kiri) disinari dengan cahaya, maka larutan tersebut tidak akan menghamburkan cahaya, sedangkan pada sistem koloid (gambar kanan), cahaya akan dihamburkan.
Hal itu terjadi karena partikel-partikel koloid mempunyai partikel-partikel yang relatif besar untuk dapat menghamburkan sinar tersebut. Sebaliknya, pada larutan sejati, partikel-partikelnya relatif kecil sehingga hamburan yang terjadi hanya sedikit dan sangat sulit diamati.
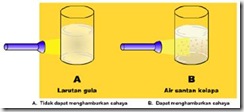
Gambar hamburan cahaya oleh air santan kelapa (koloid) dan larutan gula yang bukan koloid
Contoh efek tindal dapat dilihat pada kedua contoh berikut
Gambar penghamburan cahaya oleh sistem koloid (gambar kiri)
· Jika sinar matahari masuk melalui celah ke dalam ruangan, pada sinar tsb terlihat debu” beterbangan (daerah ini terlihat leih terang).
· Jika koen liat film di bioskop, trus ada org ngrokok. Keplaken ae wong iku pek… asap rokok yg mengepul ke atas mengakibatkan cahaya proyektor terlihat lebih terang dan gambar pada layar menjadi buram.
· Sorot lampu mobil pada malam hari yg berkabut terlihat lebih jelas, tetapip jalan kelihatan tidak jelas.
c. Adsorpsi
Adsorpsi yaitu penyerapan pada permukaan partikel koloid oleh adanya gaya adhesi zat-zat asing. Daya adsorpsi koloid sangat besar karena permukaan partikel koloid yang sangat luas bila dibandingkan permukaan zat padat dengan jumlah yang sama.
Partikel koloid sol tersebut tidak selalu mengadsorpsi ion yang sama. Hal itu tergantung pada muatan yang berlebih dari medium pendispersinya. Misalnya, jika sol AgCl terdapat pada medium pendispersi dengan kation Ag+ berlebih, maka AgCl akan bermuatan positif. Sedangkan jika AgCl terdapat pada medium pendispersi dengan anion Cl- berlebih, maka sol AgCl akan bermuatan negatif.
Koloid yang berbeda akan mengadsorpsi zat-zat yang berbeda pula. Sifat adsorpsi koloid ini umumnya digunakan untuk mengadsorpsi/membuang kotoran/warna dan bau, memisahkan campuran, memekatkan bijih tambang, dan proses pemurnian lainnya.
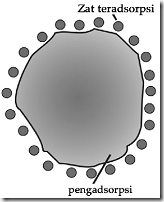
Gambar penyerapan suatu zat oleh zat pengadsorbsi

Gambar Absorbsi pada permukaan koloid
· Penjernihan air
· Penghilangan kotoran pd proses pembuatan sirup
· Proses menghilangkan bau badan
· Pengguanaan arang aktif d. Koagulasi
Koagulasi yaitu penggumpalan partikel koloid yang terjadi karena kerusakan stabilitas sistem koloid atau karena penggabungan partikel yg berbeda muatan sehinggas membentuk partikel koloid yg lebih besar. Koagulasi dapat dilakukan dengan cara mekanik dan kimiawi:
· Cara mekanik : pemanasan, pendinginan dan pengadukan.
· Cara kimiawi : penetralan silang atau menghilangkan muatan dan penambahan elektrolit.
Contoh proses-proses yang memanfaatkan sifat koagulasi dari koloid :
a) Pengolahan karet dari bahan mentahnya ( lateks ) dengan koagulan berupa asam format.
b) Proses penjernihan air dengan menambahkan tawas. Tawas aluminium sulfat (mengandung ion Al3+) dapat digunakan untuk menggumpalkan lumpur koloid atau sol tanah liat dalam air (yang bermuatan negatif).
c) Jika sol Fe(OH)3 yang bermuatan positif ditambah sol As2S3 yang bermuatan negatif, maka akan terjadi koagulasi.
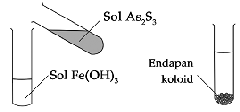
d) Proses terbentuknya delta di muara sungai. Terjadi karena koloid tanah liat dalam air sungai mengalami koagulasi ketika bercampur dengan elektrolit dalam air laut.
e) Asap atau debu pabrik dapat digumpalkan dengan alat koagulasi listrik ( pesawat Cottrel ). Metode ini dikembangkan oleh Frederick Cottrel ( 1877 – 1948 ).
f) Proses yang dilakukan oleh ion Al3+ atau Fe3+ pada penetralan partikel albuminoid yang terdapat dalam darah, mengakibatkan terjadinya koagulasi sehingga dapat menutupi luka.Pengolahan Air Bersih
Pengolahan air bersih didasarkan pada sifat-sifat koloid, yaitu koagulasi dan adsorpsi. Air sungai atau air sumur yang keruh mengandung lumpur yang merupakan partikel koloid. Selain itu terdapat pula zat-zat warna, zat pencemar, seperti limbah detergen, dan pestisida. Bahan-bahan yang diperlukan untuk pengolahan air adalah tawas biasanya aluminium sulfat, pasir, klorin atau kaporit, kapur tohor, dan karbon aktif. Tawas berguna untuk menggumpalkan lumpur agar lebih mudah disaring. Tawas juga membentuk koloid Al(OH)3 yang dapat mengadsorpsi zat-zat warna atau zat-zat pencemar, seperti detergen dan pestisida.
Apabila tingkat kekeruhan air yang diolah terlalu tinggi, maka digunakan karbon aktif di samping tawas. Pasir berfungsi sebagai penyaring. Klorin atau kaporit berfungsi sebagai pembasmi hama (desinfektan), sedangkan kapur tohor berguna untuk menaikkan pH, yaitu untuk menetralkan keasaman yang terjadi karena penggunaan tawas.
Pengolahan air bersih di kota-kota besar pada prinsipnya sama dengan pengolahan air sederhana yang dijelaskan di atas. Mula-mula air sungai dipompakan ke dalam bak prasedimentasi. Di sini lumpur dibiarkan mengendap karena pengaruh gravitasi. Lumpur dibuang dengan pompa, sedangkan air selanjutnya dialirkan ke dalam bak ventury. Pada tahap ini dicampurkan tawas dan gas klorin (preklorinasi).
Pada air baku yang kekeruhan dan pencemarannya tinggi, perlu dibubuhkan karbon aktif yang berguna untuk menghilangkan bau, warna, rasa, dan zat organik yang terkandung dalam air baku. Dari bak ventury, air baku yang telah dicampur dengan bahan-bahan kimia dialirkan ke dalam accelator. Di dalam bak accelator ini terjadi proses koagulasi, lumpur dan kotoran lain menggumpal membentuk flok-flok yang akan mengalami sedimentasi secara gravitasi. Selanjutnya, air yang sudah setengah bersih dialirkan ke dalam bak saringan pasir. Pada saringan ini, sisa-sisa flok akan tertahan. Dari bak pasir diperoleh air yang sudah hampir bersih.
Air yang sudah cukup bersih ini ditampung dalam bak lain yang disebut siphon, di mana ditambahkan kapur untuk menaikkan pH dan gas klorin (postklorinasi) untuk mematikan hama. Dari bak siphon, air yang sudah memenuhi standar air bersih selanjutnya dialirkan ke dalam reservoar, kemudian ke konsumen.
Elektroforesis
Peristiwa elektroforesis adalah peristiwa mengalirnya partikel-partikel koloid menuju elektroda, bergeraknya partikel koloid ke dalam satu elektroda menunjukkan bahwa partikel-partikel koloid bermuatan listrik. Gejala ini dapat diamati dengan menggunakan alat sel elektroforesis seperti pada gambar.
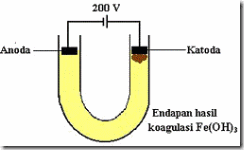
Gambar sel elektrolisis
Dengan menggunakan sel elektroforesis dapat ditentukan muatan dari partikel koloid. Elektroforesis dapat dipakai untuk memisahkan protein-protein dalam larutan. Muatan pada protein berbeda-beda, tergantung pH. Dengan membuat pH larutan tertentu (misalnya dalam larutan penyangga), pemisahan molekul-molekul protein yang berlainan jenis terjadi.
e. Koloid Pelindung
Koloid pelindung adalah koloid yang bersifat melindungi koloid lain agar tidak mengalami koagulasi sehingga koloid menjadi lebih stabil. Koloid pelindung akan membentuk lapisan di sekeliling partikel koloid yang lain. Lapisan ini akan melindungi muatan koloid tersebut sehingga partikel koloid tidak mudah mengendap atau terpisah dari medium pendispersinya.
Contohnya:
· Pada pembuatan es krim digunakan gelatin untuk mencegah pembentukan kristal besar es atau gula.
· Zat-zat pengemulsi ( sabun dan deterjen ).
· Butiran-butiran halus air dalam margarin distabilkan dengan lesitin.
· Partikel-partikel karbon dalam tinta dilindungi dengan larutan gom.
· Warna-warna dalam cat distabilkan dengan oksida logam dengan menambahkan minyak silikon.
· Pada industri susu, kasein digunakan untuk melindungi partikel-partikel minyak atau lemak dalam medium cair.
f. Koloid Liofil dan Koloid Liofob
Berdasarkan sifat adsorpsi dari partikel koloid terhadap medium pendispersinya, dikenal dua macam koloid yaitu: koloid liofil dan koloid liofob
· Koloid liofil yaitu koloid yang ”senang cairan” (bahasa Yunani : liyo = cairan; philia = senang). Partikel koloid akan mengadsorpsi molekul cairan, sehingga terbentuk selubung di sekeliling partikel koloid itu. Contoh koloid liofil adalah kanji, protein, dan agar-agar.
Ciri-cirinya Sol Liofil
1) Dapat dibuat langsung dengan mencampurkan fase terdispersi dengan medium terdispersinya
2) Mempunyai muatan yang kecil atau tidak bermuatan
3) Partikel-partikel sol liofil mengadsorpsi medium pendispersinya. Terdapat proses solvasi/ hidrasi, yaitu terbentuknya lapisan medium pendispersi yang teradsorpsi di sekeliling partikel sehingga menyebabkan partikel sol liofil tidak saling bergabung
4) Viskositas sol liofil > viskositas medium pendispersi
5) Tidak mudah menggumpal dengan penambahan elektrolit
6) Reversibel, artinya fase terdispersi sol liofil dapat dipisahkan dengan koagulasi, kemudian dapat diubah kembali menjadi sol dengan penambahan medium pendispersinya.
7) Memberikan efek Tyndall yang lemah
8) Dapat bermigrasi ke anode, katode, atau tidak bermigrasi sama sekali.
· Koloid liofob yaitu koloid yang ”benci cairan” (phobia = benci). Partikel koloid tidak mengadsorpsi molekul cairan. Contoh koloid liofob adalah sol sulfida dan sol logam.
Ciri-ciri Sol Liofob
1) Tidak dapat dibuat hanya dengan mencampur fase terdispersi dan medium pendisperinya
2) Memiliki muatan positif atau negative
3) Partikel-partikel sol liofob tidak mengadsorpsi medium pendispersinya. Muatan partikel diperoleh dari adsorpsi partikel-partikel ion yang bermuatan listrik
4) Viskositas sol hidrofob hampir sama dengan viskositas medium pendispersi
5) Mudah menggumpal dengan penambahan elektrolit karena mempunyai muatan
6) Irreversibel artinya sol liofob yang telah menggumpal tidak dapat diubah menjadi sol
7) Memberikan efek Tyndall yang jelas
8) Akan bergerak ke anode atau katode, tergantung jenis muatan partikel
KESTABILAN SISTEM KOLOID
Koloid gas dan kebanyakan koloid cairan tidak mengendap dalam waktu yang sangat lama. Hal ini menunjukan koloid stabil. Kestabilan koloid ini disebabkan karena adanya gerak Brown. Meskipun telah sampai ke dasar wadah, partikel koloid dapat naik kembali dan terus bergerak dalam mediumnya. Penyebab lainnya karena umumnya partikel koloid mengadsorpsi ion. Partikel koloid yang sama akan mengadsorpsi ion-ion yang sejenis, sehingga partikel-partikel koloid itu saling tolak-menolak karena pengaruh ion sejenis yang telah diadsorpsi.
Partikel koloid sebenarnya tidak bermuatan listrik (netral). Peristiwa elektroforesis dapat digunakan untuk mengetahui jenis muatan ion yang diadsorpsi koloid. Jika koloid mengumpul pada elektroda negatif, berarti koloid telah mengadsorpsi ion positip, dan sebaliknya.
Kestabilan koloid dapat juga disebabkan adanya adsorpsi molekul atau koloid yang lain (koloid protektif/pelindung). Misalnya gelatin sebagai penstabil es krim. Emulsi dapat terbentuk karena adanya koloid lain (emulgator/pengemulsi) sebagai pengadsorpsi. Misalnya sabun sebagai pengemulsi minyak/lemak dan air.
Pengemulsi yang lain misalnya kasein dalam susu, dan kuning telur dalam pembuatan mayones. Jika partikel-partikel koloid saling bergabung dan terkumpul menjadi partikel yang semakin besar, maka koloid akan terkoagulasi (menggumpal) dan akhirnya akan mengendap.
Secara kimia koagulasi partikel koloid dapat terjadi karena ion-ion yang telah diadsorpsi partikel koloid dilucuti atau dinetralkan. Misalnya dengan cara elektrolisis atau dicampurkan elektrolit/ion yang muatannya berlawanan. Cara lain yaitu dicapur dengan koloid lain yang telah mengadsorpsi ion yang muatannya berlawanan. Ion-ion itu akan saling tarik menarik dengan membawa serta partikel koloid yang mengadsorpsinya. Secara fisika koagulasi koloid dapat terjadi karena pemanasan atau pendinginan. Misalnya telur atau santan kelapa dapat menggumpal jika dipanaskan. Es lilin bisa menjadi keras karena didinginkan.
PEMBUATAN SISTEM KOLOID
Terdapat dua cara pembuatan koloid yaitu cara kondensasi dan cara dispersi.
1. Cara Kondensasi
Reaksi dekomposisi rangkap.
Misalnya:
1. koloid As2S3 dibuat dengan gaya mengalirkan H2S dengan perlahan-lahan melalui larutan As2O3 dingin sampai terbentuk sol As2S3 yang berwarna kuning terang.
As2O3(aq) + 3H2S(g) → As2O3 (koloid) + 3H2O(l)
Koloid As2S3 bermuatan negatif karena permukaannya menyerap ion S2
2. sol AgCl dibuat dengan mencampurkan larutan AgNO3 encer dan larutan HCl encer. Reaksinya:
AgNO3(ag) + HCl(aq) → AgCl (koloid) + HNO3(aq)
Reaksi redoks.
Misalnya: sol emas atau sol Au dapat dibuat dengan mereduksi larutan garamnya dengan melarutkan AuCl3 dalam pereduksi organik formaldehida HCOH. Reaksi yang terjadi:
2AuCl (aq) + HCOH(aq) + 3H2O(l) → 2Au(s) + HCOOH(aq) + 6HCl(aq)
Sedangkan sol belerang dapat dibuat dengan mereduksi SO2 yang terlarut dalam air dengan mengalirinya gas H2S. Reaksi kimia yang terjadi:
2H2S(g) + SO2(aq) → 3S(s) + 2H2O
Reaksi hidrolisis.
Hidrolisis adalah reaksi suatu zat dengan air. Misalanya: sol Fe(OH)3 dapat dibuat dengan hidrolisis larutan FeCl3 dengan memanaskan larutan FeCl3 atau reaksi hidrolisis garam Fe dalam air mendidih.
FeCl3(aq) + 3H2O(l) → Fe(OH)3 (koloid) + 3HCl(aq)
(Koloid Fe(OH)3 bermuatan positif karena permukaannya menyerap ion H+).
Sol Al(OH)3 dapat diperoleh dari reaksi hidrolisis garam Al dalam air mendidih.
AlCl3(aq) + 3H2O(l) → Al(OH)3 (koloid) + 3HCl(aq)
Reaksi pergantian pelarut
Cara ini dilakukan dengan mengganti medium pendispersi sehingga fasa terdispersi yang semulal arut setelah diganti pelarutanya menjadi berukuran koloid. Misalnya: untuk membuat sol belerang yang sukar larut dalam air tetapi mudah larut dalam alkohol seperti etanol dengan medium pendispersi air, belarang harus terlebih dahulu dilarutkan dalam etanol sampai jenuh. Baru kemudian larutan belerang dalam etanol tersebut ditambahkan sedikit demi sedikit ke dalam air sambil diaduk. Sehingga belerang akan menggumpal menjadi pertikel koloid dikarenakan penurunan kelarutan belerang dalam air.
Sebaliknya, kalsium asetat yang sukar larut dalam etanol, mula-mula dilarutkan terlebih dahulu dalam air, kemudianbaru dalam larutan tersebut ditambahkan etanol maka terjadi kondensasi dan terbentuklah koloid kalsium asetat.
2. Cara Dispersi
Cara Mekanik
Cara mekanik adalah penghalusan partikel-partikel kasar zat padat dengan proses penggilingan untuk dapat membentuk partikel-partikel berukuran koloid. Alat yang digunakan untuk cara ini biasa disebut penggilingan koloid, yang biasa digunakan dalam:
Ø Industri makanan untuk membuat jus buah, selai, krim, es krim,dsb.
Ø Industri kimia rumah tangga untuk membuat pasta gigi, semir sepatu, deterjen, dsb.
Ø Industri kimia untuk membuat pelumas padat, cat dan zat pewarna.
Ø Industri-industri lainnya seperti industri plastik, farmasi, tekstil, dan kertas.
Cara Peptisasi
Cara peptisasi adalah pembuatan koloid/sistem koloid dari butir-butir kasar atau dari suatu endapan/proses pendispersi endapan dengan bantuan suatu zat pemeptisasi (pemecah). Zat pemecah tersebut dapat berupa elektrolit khususnya yang mengandung ion sejenis ataupun pelarut tertentu. Contoh:
Ø Agar-agar dipeptisasi oleh air, karet oleh bensin
Ø Endapan NiS dipeptisasi oleh H2S, endapan Al(OH)3 oleh AlCl3
Ø Sol Fe(OH)3 diperoleh dengan mengaduk endapan Fe(OH)3 yang baru terbentuk dengan sedikit FeCl3. Sol Fe(OH)3 kemudian dikelilingi Fe+3 sehingga bermuatan positif
Ø Beberapa zat mudah terdispersi dalam pelarut tertentu dan membnetuk sistem koloid. Contohnya: gelatin dalam air.
Cara Busur Bredig
Cara busur Bredig ini biasanya digunakan untuk membuat sol-sol logam, sperti Ag, Au, dan Pt. Dalam cara ini, logam yang akan diubah menjadi partikel-partikel kolid akan digunakan sebagai elektrode. Kemudian kedua logam dicelupkan ke dalam medium pendispersinya (air suling dingin) sampai kedua ujungnya saling berdekatan. Kemudian, kedua elektrode akan diberi loncatan listrik, seperti gambar.
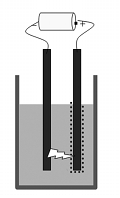
Gambar Cara busur listrik Bredig
Panas yang timbul akan
menyebabkan logam menguap, uapnya kemudian akan terkondensasi dalam
medium pendispersi dingin, sehingga hasil kondensasi tersebut berupa
pertikel-pertikel kolid. Karena logam diubah jadi partikel kolid dengan
proses uap logam, maka metode ini dikategorikan sebagai metode dispersi.PEMURNIAN KOLOID
1) Dialisis
Dialisis ialah pemisahan koloid dari ion-ion pengganggu dengan cara ini disebut proses dialisis. Yaitu dengan mengalirkan cairan yang tercampur dengan koloid melalui membran semipermeabel yang berfungsi sebagai penyaring. Membran semipermeabel ini dapat dilewati cairan tetapi tidak dapat dilewati koloid, sehingga koloid dan cairan akan berpisah.
Salah satu pemanfaatan proses dialysis adalah alat pencuci darah (Haemodialisis). Pada proses ini darah kotor dari pasien dilewatkan dalam pipa-pipa yang terbuat dari membran semipermeable. Pipa semipermeable ini dialiri cairan yang berfungsi sebagai pencuci (biasanya plasma darah), ion-ion dalam darah kotor akan terbawa aliran plasma darah.
2) Penyaring Ultra
Partikel-partikel kolid tidak dapat disaring biasa seperti kertas saring, karena pori-pori kertas saring terlalu besar dibandingkan ukuran partikel-partikel tersebut. Tetapi, bila kertas saring tersebut diresapi dengan selulosa seperti selofan, maka ukuran pori-pori kertas akan sering berkurang. Kertas saring yang dimodifikasi tersebut disebut penyaring ultra.
Proses pemurnian dengan menggunakan penyaring ultra ini termasuk lambat, jadi tekanan harus dinaikkan untuk mempercepat proses ini. Terakhir, partikel-pertikel koloid akan teringgal di kertas saring. Partikel-partikel kolid akan dapat dipisahkan berdasarkan ukurannya, dengan menggunakan penyaring ultra bertahap.
No comments:
Post a Comment