Spektrofotometri
visible disebut juga spektrofotometri sinar tampak. Yang dimaksud sinar
tampak adalah sinar yang dapat dilihat oleh mata manusia. Cahaya yang
dapat dilihat oleh mata manusia adalah cahaya dengan panjang gelombang
400-800 nm dan memiliki energi sebesar 299–149 kJ/mol.
Elektron pada keadaan normal atau berada pada kulit atom dengan energi terendah disebut keadaan dasar (ground-state).
Energi yang dimiliki sinar tampak mampu membuat elektron tereksitasi
dari keadaan dasar menuju kulit atom yang memiliki energi lebih tinggi
atau menuju keadaan tereksitasi.
Cahaya yang diserap oleh suatu zat berbeda dengan cahaya yang ditangkap
oleh mata manusia. Cahaya yang tampak atau cahaya yang dilihat dalam
kehidupan sehari-hari disebut warna komplementer.
Misalnya suatu zat akan berwarna orange bila menyerap warna biru dari
spektrum sinar tampak dan suatu zat akan berwarna hitam bila menyerap
semua warna yang terdapat pada spektrum sinar tampak. Untuk lebih
jelasnya perhatikan tabel berikut.
|
Panjang gelombang (nm) |
Warna warna yang diserap |
Warna komplementer (warna yang terlihat) |
|
400 – 435 |
Ungu |
Hijau kekuningan |
|
435 – 480 |
Biru |
Kuning |
|
480 – 490 |
Biru kehijauan |
Jingga |
|
490 – 500 |
Hijau kebiruan |
Merah |
|
500 – 560 |
Hijau |
Ungu kemerahan |
|
560 – 580 |
Hijau kekuningan |
Ungu |
|
580 – 595 |
Kuning |
Biru |
|
595 – 610 |
Jingga |
Biru kehijauan |
|
610 – 800 |
Merah |
Hijau kebiruan |
Pada spektrofotometer sinar tampak, sumber cahaya biasanya menggunakan lampu tungsten yang sering disebut lampu wolfram.
Wolfram merupakan salah satu unsur kimia, dalam tabel periodik unsur
wolfram termasuk golongan unsur transisi tepatnya golongan VIB atau
golongan 6 dengan simbol W dan nomor atom 74. Wolfram digunakan sebagai
lampu pada spektrofotometri tidak terlepas dari sifatnya yang memiliki
titik didih yang sangat tinggi yakni 5930 °C.
Gambar 2 jenis
spektronic-20 yang bekerja pada rentang panjang gelombang sinar tanpak.
Gambar atas merupakan spectronic-20 lama yang sudah jarang bahkan
mungkin tidak diproduksi lagi. Sedangkan gambar kedua adalah
spectronic-20 terbaru.
Panjang gelombang yang digunakan untuk melakukan analisis adalah panjang
gelombang dimana suatu zat memberikan penyerapan paling tinggi yang
disebut λmaks. Hal ini disebabkan jika pengukuran dilakukan
pada panjang gelombang yang sama, maka data yang diperoleh makin akurat
atau kesalahan yang muncul makin kecil.
Berdasarkan hukum Beer absorbansi akan berbanding lurus dengan konsentrasi, karena b atau l harganya 1 cm dapat diabaikan dan ε merupakan suatu tetapan.
Artinya konsentrasi makin tinggi maka absorbansi yang dihasilkan makin
tinggi, begitupun sebaliknya konsentrasi makin rendah absorbansi yang
dihasilkan makin rendah. (Hukum Lamber-Beer dan syarat peralatan yang
digunakan agar terpenuhi hukum Lambert-Beer Baca Pengertian Dasar Spektrofotometer Vis, UV, UV-Vis)
-
Adanya serapan oleh pelarut. Hal ini dapat diatasi dengan penggunaan blangko, yaitu larutan yang berisi selain komponen yang akan dianalisis termasuk zat pembentuk warna.
-
Serapan oleh kuvet. Kuvet yang ada biasanya dari bahan gelas atau kuarsa, namun kuvet dari kuarsa memiliki kualitas yang lebih baik.
-
Kesalahan fotometrik normal pada pengukuran dengan absorbansi sangat rendah atau sangat tinggi, hal ini dapat diatur dengan pengaturan konsentrasi, sesuai dengan kisaran sensitivitas dari alat yang digunakan (melalui pengenceran atau pemekatan).
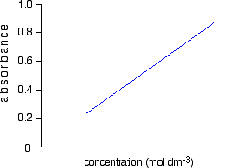
Hubungan
antara absorbansi terhadap konsentrasi akan linear (A≈C) apabila nilai
absorbansi larutan antara 0,2-0,8 (0,2 ≤ A ≥ 0,8) atau sering disebut
sebagai daerah berlaku hukum Lambert-Beer. Jika absorbansi yang
diperoleh lebih besar maka hubungan absorbansi tidak linear lagi. Kurva
kalibarasi hubungan antara absorbansi versus konsentrasi dapat dilihat
pada Gambar.
Gambar Kurva hubungan absorbansi vs konsentrasi
Faktor-faktor yang menyebabkan absorbansi vs konsentrasi tidak linear:
-
Kestabilan dalam larutan. Pereaksi-pereaksi yang berubah sifatnya dalam waktu beberapa jam, dapat menyebabkan timbulnya semacam cendawan bila disimpan. Oleh sebab itu harus dibuat baru dan kurva kalibarasi yang baru harus dibuat saat setiap kali analisis.
-
Pembentukan warna yang dianalisis harus cepat.
-
Reaksi dengan komponen yang dianalisa harus berlangsung secara stoikiometrik.
-
Pereaksi tidak boleh menyerap cahaya dalam spektrum dimana dilakukan pengukuran.
-
Pereaksi harus selektif dan spesifik (khas) untuk komponen yang dianalisa, sehingga warna yang terjadi benar-benar merupakan ukuran bagi komponen tersebut saja.
-
Tidak boleh ada gangguan-gangguan dari komponen-komponen lain dalam larutan yang dapat mengubah zat pereaksi atau komponen komponen yang dianalisa menjadi suatu bentuk atau kompleks yang tidak berwarna, sehingga pembentukan warna yang dikehandaki tidak sempurna.
-
Pereaksi yang dipakai harus dapat menimbulkan hasil reaksi berwarna yang dikehendaki dengan komponen yang dianalisa, dalam pelarut yang dipakai.
Zat
yang dapat dianalisis menggunakan spektrofotometri sinar tampak adalah
zat dalam bentuk larutan dan zat tersebut harus tampak berwarna,
sehingga analisis yang didasarkan pada pembentukan larutan berwarna
disebut juga metode kolorimetri.
Jika
tidak berwarna maka larutan tersebut harus dijadikan berwarna dengan
cara memberi reagen tertentu yang spesifik. Dikatakan spesifik karena
hanya bereaksi dengan spesi yang akan dianalisis. Reagen ini disebut reagen pembentuk warna (chromogenik reagent). Berikut adalah sifat-sifat yang harus dimiliki oleh reagen pembentuk warna:
-
Kestabilan warna yang cukup lama guna memungkinkan pengukuran absorbansi dengan teliti. Ketidakstabilan, yang mengakibatkan menyusutnya warna larutan (fading), disebabkan oleh oksidasi oleh udara, penguraian secara fotokimia, pengaruh keasaman, suhu dan jenis pelarut. Namun kadang-kadang dengan mengubah kondisi larutan dapat diperoleh kestabilan yang lebih baik.
-
Warna larutan yang akan diukur harus mempunyai intensitas yang cukup tinggi (warna harus cukup tua) yang berarti bahwa absortivitas molarnya (ε) besar. Hal ini dapat dikontrol dengan mengubah pelarutnya. Dalam hal ini dengan memilih pereaksi yang memiliki kepekaan yang cukup tinggi.
-
Warna larutan yang diukur sebaiknya bebas daripada pengaruh variasi-variasi kecil kecil dalam nilai pH, suhu maupun kondisis-kondisi yang lain.
-
Hasil reaksi yang berwarna ini harus larut dalam pelarut yang dipakai.
-
Sistem yang berwarna ini harus memenuhi Hukum Lambert-Beer.
Setelah ditambahkan reagen atau zat pembentuk warna maka larutan tersebut harus memiliki lima sifat di bawah ini:
-
Maching kuvet : mencari dua buah kuvet yang memiliki absorbansi atau transmitansi sama atau hampir sama. Dua buah kuvet inilah yang akan digunakan untuk analisis, satu untuk blanko, satu untuk sampel. Dalam melakukan analisis Maching kuvet harus dilakukan agar kesalahannya makin kecil.
-
Membuat larutan standar pada berbagai konsentrasi. Larutan standar yaitu larutan yang konsentrasinya telah diketahui secara pasti. Konsentrasi larutan standar dibuat dari yang lebih kecil sampai lebih besar dari konsentrasi analit yang diperkirakan.
-
Ambilah salah satu larutan standar, kemudian ukur pada berbagai panjang gelombang. Hal ini dilakukan untuk mengetahui pada panjang gelombang berapa, absorbansi yang dihasilkan paling besar. Panjang gelombang yang menghasilkan absorbansi paling besar atau paling tinggi disebut panjang gelombang maksimum (lmaks).
-
Ukurlah absorbansi semua larutan standar yang telah dibuat pada panjang gelombang maksimum.
-
Catat absorbansi yang dihasilkan dari semua larutan standar, kemudian alurkan pada grafik absorbansi vs konsentrasi sehingga diperoleh suatu kurva yang disebut kurva kalibarasi. Dari hukum Lambart-Beer jika absorbansi yang dihasilkan berkisar antara 0,2-0,8 maka grafik akan berbentuk garis lurus, namun hal ini tidak dapat dipastikan.
Menentukan konsentrasi sampel dengan cara kurva kalibrasi
Konsentrasi sampel dalam suatu larutan dapat ditentukan dengan rumus
yang diturunkan dari hukum lambert beer (A= a . b . c atau A = ε . b .
c). Namun ada cara lain yang dapat digunakan untuk menentukan
konsentrasi suatu spesi yang ada dalam suatu larutan yakni dengan cara kurva kalibarasi. Cara ini sebenarnya masih tetap bertumpu pada hukum Lambert-Beer yakni absorbansi berbanding lurus dengan konsentrasi.
Langkah-langkah yang perlu dilakukan dalam penentuan konsentrasi zat dengan kurva kalibarasi:
Misalkan absorbansi yang dihasilkan dari larutan standar yang telah dibuat adalah
|
Absorbansi |
0,2 |
0,3 |
0,4 |
0,5 |
0,6 |
0,7 |
0,8 |
0,9 |
|
konsentrasi |
2 ppm |
4 ppm |
6 ppm |
8 ppm |
10 ppm |
12 ppm |
14 ppm |
16 ppm |
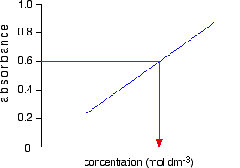
Grafiknya adalah
6. Ukurlah
absorbansi larutan yang belum diketahui konsentrasinya. Setelah
diperoleh absorbansinya, masukan nilai tersebut pada grafik yang
diperoleh pada langkah 5. Misalkan absorbansi yang diperoleh 0,6. Maka
jika ditarik garis lurus konsentrasi sampel akan sama dengan konsentrasi
larutan standar 10 ppm. Maka grafiknya sebagai berikut:
Selain dengan cara diatas konsentrasi sampel dapat dihitung dengan persamaan regresi linear:
persamaan di
atas dapat dihitung dengan bantuan kalkulator. Setelah diperoleh
persamaan di atas, absorbansi sampel yang diperoleh dimasukan sebagai
nila y sehingga diperoleh nila x. Nilai x yang diperoleh merupakan
konsentrasi sampel yang dianalisis.



No comments:
Post a Comment