Selain dari
ikatannya, terdapat cara lain untuk mengelompokan senyawa yakni
didasarkan pada daya hantar listrik. Jika suatu senyawa dilarutkan dalam
air dapat menghantarkan arus listrik disebut larutan elektrolit, dan sebaliknya jika larutan tersebut tidak dapat menghantarkan arus listrik disebut larutan nonelektrolit.
Glukosa (C6H12O6), etanol (C2H5OH), gula tebu (C12H22O11), larutan urea (CO(NH2)2) merupakan beberapa contoh senyawa yang dalam bentuk padatan, lelehan maupun larutan tidak dapat menghantarkan arus listrik.
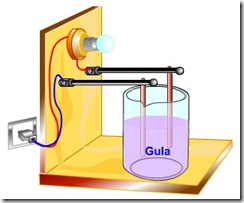
Cara pengujian
suatu senyawa termasuk elektrolit atau nonelektrolit dapat dilakukan
dengan meghubungkan baterai dan lampu bohlam atau amperemeter kemudian
ujung kabel dihubungkan pada dua buah elektroda. Satu sebagai anoda (+),
satu sebagai katoda (-).
Setelah semua
terhubung pengujian dapat dilakukan dengan mencelupkan kedua elektroda
ke dalam larutan yang akan diuji dan perhatikan agar kedua elektrode
tidak bersentuhan.
Ketika elektroda dicelupkan, jika lampu bohlam menyala dan atau
terbentuk gelembung udara pada kedua elektroda maka senyawa atau zat
tersebut termasuk golongan senyawa elektrolit.
Begitu pula
sebaliknya, ketika elektroda dicelupkan lampu bohlam tidak menyala dan
atau tidak terbentuk gelembung udara pada kedua elektroda, maka senyawa
atau zat tersebut termasuk golongan senyawa nonelektrolit.
Gambar Rangkaian Alat pengujian larutan
Mengapa Larutan Menghantarkan Arus Listrik
Larutan
elektrolit dapat menghantarkanarus listrik sedangkan larutan
nonelektrolit tidak menghantarkan arus listrik, telah dijelaskan oleh
seorang ahli kimia swedia Svante August Arrhenius (1859-1927).
Didasarkan pada teori ionisasi Arhenius, larutan elektrolit dapat
menghantarkan arus listrik karena di dalam larutan terkandung atom-atom
atau kumpulan atom yang bermuatan listrik yang bergerak bebas. Atom atau
kumpulan atom yang bermuatan listrik disebut ion.
Perubahan suatu senyawa menjadi ion-ion dalam suatu larutan disebut proses ionisasi. Proses
ionisasi merupakan salah satu cara menunjukan pembentukan ion-ion,
umumnya ditulis tanpa melibatkan molekul air atau pelarut, namun
terkadang molekul air dituliskan juga. Misalnya HCl yang dilarutkan
dalam air dapat ditulis dalam dua persamaan:
Ketika diberi
beda potensial, Ion yang bermuatan negatif bergerak menuju anoda (+)
sedangkan ion yang bermuatan positif bergerak menuju katoda (-) karena
adanya perbedaan muatan. Aliran ion inilah yang menyebabkan larutan
elektrolit dapat menghantarkan arus listrik.
Senyawa seperti
glukosa, etanol, gula tebu dan larutan urea dalam bentuk padatan,
lelehan maupun larutan tidak dapat menghantarkan arus listrik karena
tidak mengalami ionisasi atau tetap dalam bentuk molekul.
Sumber Ion Dalam Larutan Elektrolit
Ion-ion yang timbul dalam larutan elektrolit terdiri dari dua sumber yaitu senyawa ionik dan senyawa kovalen polar.
Senyawa Ionik
Senyawa ionik
tersusun atas ion-ion sekalipun dalam dalam bentuk padat atau kering.
Misalnya NaCl dan NaOH. NaCl tersusun dari ion Na+ dan ion Cl¯ sedangkan NaOH tersusun dari ion Na+ dan ion OH–.
Senyawa-senyawa
ionik dalam keadaan padat tidak dapat menghantarkan arus listrik karena
ion-ion yang terikata dengan kuat, sehingga tidak ion-ion tersebut
tidak mengalami mobilisasi ketika diberi beda potensial.
Namun apabila
senyawa ionik dilarutkan dalam pelarut polar misalnya air, maka senyawa
ionik adalah suatu elektrolit. Hal ini disebabkan ion-ion yang awalnya
terikat kuat pada kisi terlepas kemudian segera masuk dan menyebar
dengan air sebagai medium untuk bergerak.
Perlu diketahui
bahwa semua senyawa ionik yang yang dapat larut dalam pelarut polar
seperti air dan lelehan senyawa ionik merupakan suatu elektrolit. Tetapi
lelehan senyawa ionik memiliki daya hantar listrik yang lebih baik
dibanding larutannya.
Hal ini
disebabkan susunan ion-ion dalam lelehan senyawa ionik lebih rapat
dibanding dalam bentuk larutan, sehingga ion-ion yang ada lebih mudah
atau lebih cepat bergerak menuju anoda dan katoda ketika diberi beda
potensial.
Senyawa kovalen polar
Senyawa-senyawa
kovalen baik kovalen polar maupun nonpolar dalam keadaan murni tidak
dapat menghantarkan arus listrik. Tetapi senyawa kovalen polar dapat
menghantarkan arus listrik jika dilarutkan dalam pelarut yang sesuai.
Hal ini disebabkan senyawa kovalen polar dalam pelarut yang sesuai mampu
membentuk ion-ion.
Misalnya
senyawa kovalen polar mampu membentuk ion di dalam air sehingga dapat
menghantar arus listrik. Tetapi senyawa kovalen polar tidak mampu
membentuk ion di dalam benzena sehingga tidak dapat menghantarkan arus
listrik. HCl, NH3 dan CH3COOH merupakan beberapa contoh senyawa kovalen polar.
Elektrolit Kuat dan Elektrolit Lemah
Senyawa yang
seluruhnya atau hampir seluruhnya di dalam air terurai menjadi ion-ion
sehingga memiliki daya hantar listrik yang baik disebut elektrolit kuat. Senyawa
yang termasuk elektrolit kuat mempunyai daya hantar listrik yang
relatif baik walaupun memiliki konsentrasi yang kecil. Sebaliknya
senyawa yang sebagian kecil terurai menjadi ion disebut elektrolit lemah.
Senyawa yang termasuk elektrolit lemah mempunyai daya hantar yang relatif jelek walaupun memiliki konsentrasi tinggi (pekat). Beberapa contoh elektrolit kuat dan elektrolit lemah seperti yang tertera pada Tabel.
|
Elektrolit kuat |
Nama |
Elektrolit lemah |
Nama |
|
HCl H2SO4 NaCl NaOH |
Asam klorida Asam sulfat Natrium klorida Natrium hidroksida |
CH3COOH NH3 NH4OH H2S |
Asam asetat Amonia Amonium klorida Asam sulfida |
Menggunakan rangkaian seperti pada Gambar, suatu larutan termasuk elektrolit kuat atau lemah dapat diketahui.
Larutan yang memberikan nyala bohlam terang termasuk elektrolit kuat
sedangkan elektrolit lemah nyala bohlamnya redup atau hanya menimbulkan
gelembung-gelumbung udara pada elektroda. Jika tidak ada reaksi atau
perubahan apa-apa ketika kedua elektroda dicelupkan, maka larutan
tersebut termasuk larutan nonelektrolit.
Misalnya HCl, CH3COOH dan NH3, apabila diuji daya hantar listrik menggunakan konsentrasi larutan yang sama misalnya 1 M.
Maka dapat diketahui ternyata HCl memiliki daya hantar listrik yang
lebih baik dibanding dua senyawa lainnya. Hal ini dapat dilihat dari
lampu bohlam yang menyala lebih terang.
Menggunakan
teori Arhenius dapat disimpulkan bahwa jumlah ion yang terbentuk dari
HCl lebih banyak dibanding dua senyawa lainnya. Artinya di dalam air
sebagian besar HCl terurai menjadi ion H+ dan ion Cl‾ sedangkan CH3COOH dan NH3 hanya sebagian kecil yang terurai ion H+ dan ion CH3COO‾ dan NH4+ dan OH‾ atau sebagian besarnya masih tetap dalam bentuk molekul kovalen.
Elektrolit asam, basa dan Garam
Larutan elektrolit dapat berupa asam, basa dan garam. Untuk asam dan basa dapat berupa elektrolit kuat dan elektrolit lemah.
Sedangkan garam yang mudah larut dalam air semuanya termasuk elektrolit
kuat. Garam-garam yang sukar larut dalam air berupa elektrolit lemah
walaupun tersusun atas ion-ion.
Beberapa senyawa yang tergolong elektrolit kuat adalah
-
Asam-asam kuat umumnya asam-asam anorganik, misalnya: HCl, HClO3, H2SO4 dan HNO3.
-
Basa-basa kuat yaitu basa-basa golongan alkali dan alkali tanah, misalnya: NaOH, KOH, Ca(OH)2 dan Ba(OH)2.
-
Garam-garam yang mudah larut, misalnya: NaCl, KI dan Al2(SO4)3
Beberapa senyawa yang tergolong elektrolit lemah
-
Asam-asam lemah, sebagian asam anorganik dan sebagian besar asam organik misalnya: CH3COOH, HCN, H2CO3 dan H2S.
-
Basa-basa lemah, misalnya amonia dan kebanyakan basa organik seperti NH4OH dan Ni(OH)2.
-
Garam-garam yang sukar larut, misalnya: AgCl, CaCrO4 dan PbI2
Derajat Ionisasi
Ketika suatu
zat dilarutkan dalam air, maka terdapat 3 kemungkinan yang terjadi yakni
zat tersebut larut secara sempurna, larut sebagian dan tidak larut
dalam air. Banyaknya spesi yang terionisasi dalam air dapat diketahui menggunakan derajat disosiasi atau derajat ionisasi (α).
Derajat ionisasi diartikan sebagai perbandingan jumlah mol atau molekul zat yang terionisasi dengan banyaknya mol atau molekul zat mula-mula. Derajat ionisasi dapat ditulis sebagai
|
|
Harga α di antara 0 ≤ α ≥ 1. α ≤ 0 artinya tidak terjadi ionisasi, sedangkan α ≥ 1 artinya terjadi ionisasi secara sempurna.
Contoh soal
Bila diketahui suatu reaksi sebagai berikut
Dari reaksi di atas tentukan derajat ionisasinya, bila mula-mula 2 mol asam asetat dilarutkan dalam air dan menghasilkan ion H+ sebanyak 0,5 mol.
Jawab
Derajat ionisasinya adalah
Contoh soal
Suatu basa dengan rumus L(OH)2 bila dilarutkan dalam air teionisasi sesuai reaksi berikut:
Jika mula-mula L(OH)2 sebanyak 2 mol dengan derajat ionisasi sebesar 0,3. Tentukanlah
a. Jumlah mol L(OH)2 yang terionisasi
b. Jumlah mol ion L2+ yang terbentuk
c. Jumlah mol L(OH)2 yang tersisa setelah terionisasi
Jawab
a. Jumlah mol L(OH)2 yang terionisasi
b. Jumlah mol ion L2+ yang terbentuk
c. Jumlah mol L(OH)2 yang tersisa setelah terionisasi
No comments:
Post a Comment