Ester merupakan kelompok senyawa organik yang memiliki rumus umum RCOOR1. Ester termasuk turunan asam karboksilat yang gugus –OH dalam rumus RCOOH diganti oleh gugus –OR1. Dengan demikian rumus umum ester adalah
TATANAMA ESTER
Pemberian nama
pada ester diawali dengan menyebut nama gugus alkil atau aril yang
menggantikan atom H dalam gugus –COOH pada asam asam karboksilat
induknya kemudian di ikuti nama asam tersebut tanpa menyebut kata asam.
Contoh
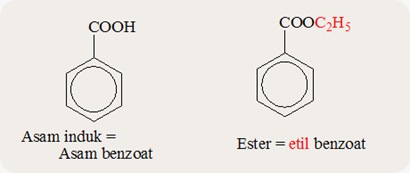
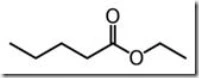
Asam induk = CH3CH2CH2COOH
IUPAC = asam pentanoat
Trivial = asam valerat
Ester = CH3CH2CH2COOC2H5
IUPAC = etil pentanoat
Trivial = etil valerat
3-metilbutil asetat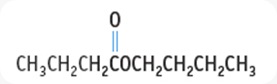
Butil butanoat
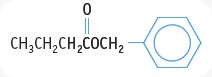
Benzil butanoat
PEMBUATAN ESTER
Ester dibuat
dengan mereaksikan alkohol atau fenol dengan asam karboksilat kemudian
direfluks. Fenol yaitu senyawa organik dimana gugus -OH langsung terikat
pada cincin benzena. Reaksi pembuatan ester disebut esterifikasi dan reaksi yang terjadi disebut reaksi esterifikasi Fischer.
Reaksi esterifikasi merupakan reaksi reversibel yang sangat lambat,
tetapi bila menggunakan katalis asam mineral seperti asam sulfat (H2SO4)
dan asam klorida (HCl) kesetimbangan akan tercapai dalam waktu yang
cepat. Pola umum dalam pembuatan ini dinyatakan dengan persamaan berikut
RCOOH + R1OH ↔ RCOOR1 + H2O
Dalam reaksi esterifikasi, ion H+ dari H2SO4
berperan dalam pembentukan ester dan juga berperan dalam reaksi
sebaliknya yakni hidrolisis ester. Sesuai dengan hukum aksi massa, untuk
memperoleh rendemen ester yang tinggi maka kesetimbangan harus bergeser
ke arah pembentukkan ester. Untuk mencapai keadaan ini dapat ditempuh
dengan cara:
a. Salah satu pereaksi digunakan secara berlebih. Biasanya alkohol dibuat berlebih karena murah dan mudah diperoleh.
b. Membuang salah satu produk dari dalam campuran reaksi
Laju reaksi
esterifikasi suatu asam karboksilat bergantung pada halangan sterik
dalam alkohol dan asam karboksilatnya. Dengan bertambahnya halangan
sterik di dalam zat antara, laju pembentukkan ester akan menurun. Dengan
demikian rendemen ester akan berkurang.
Esterifikasi
dipengaruhi oleh beberapa faktor, diantaranya adalah struktur molekul
dari alkohol, suhu dan konsentrasi reaktan maupun katalis. Kereaktifan
alkohol terhadap esterifikasi: CH3OH > alkohol primer > alkohol sekunder > alkohol tersier
Kereaktifan asam karboksilat terhadap esterifikasi : HCOOH > CH3COOH > RCH2COOH > R2CHCOOH > R3CCOOH
Selain dibuart
dari asam karboksilat, ester juga dapat diperoleh dengan cara
mereaksikan suatu klorida asam atau suatu anhidrida asam dengan alkohol
atau fenol. Reaksi pembuatan ester dari klorida asam dan anhidrida asam
mengikuti pola umum reaksi berikut.
Klorida asam
RCOCl + R1OH → RCOOR1 + HCl
RCOCl + ArOH → RCOOAr + HCl
Anhidrida asam
(RCO)2O + R1OH → RCOOR1 + RCOOH
(RCO)2O + ArOH → RCOOAr + RCOOH
REAKSI-REAKSI ESTER
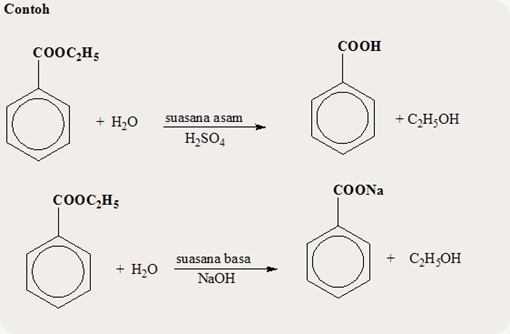
a. Reaksi hidrolisis
Reaksi
hidrolisis ester dalam suasana asam menghasilkan asam karboksilat dan
alkohol, namun bila reaksi hidrolisis dilangsungkan dalam suasana basa
diperoleh garam karboksilat dan alkohol. Hidrolisis ester dengan basa
dise4but reaksi Penyabunan (Saponifikasi).
b. Reaksi dengan Amonia
Produk reaksi antara ester dengan amonia adalah suatu amida dan suatu alkohol. Contoh : reaksi antara etil asetat dengan amonia menghasilkan asetamida dan etanol.
CH3COOC2H5 + NH3 → CH3CONH2 + C2H5OH
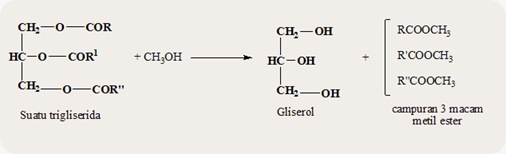
c. Transesterifikasi
Jika suatu
ester direaksikan dengan suatu alkohol maka akan diperoleh ester baru
dan alkohol baru. Reaksi ini disebut reaksi transesterifikasi yang dapat
berlangsung dalam suasana asam dan basa mengikuti pola umum berikut
ini.
RCOOR1 + R”OH ↔ RCOOR” + R1OH
Reaksi diatas disebut transesterifikasi karena terjadi pertukaran antara gugus alkil dalam –OR1 pada ester dengan gugus alkil dalam ikatan R”O.
Contoh reaksi antara suatu trigliserida dengan metanol.
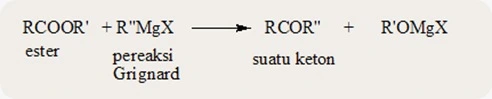
d. Reaksi dengan pereaksi Grignard
Reaksi antara
suatu ester dengan pereaksi Grignard merupakan cara istimewa dalam
pembuatan alkohol tersier. Pola umum dari reaksi ini adalah sebagai
berikut.
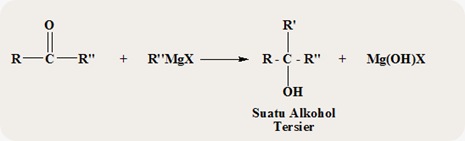
Bila keton yang
diperoleh di atas direaksikan lebih lanjut dengan R’’MgX maka pada
akhirnya diperoleh suatu alkohol terseir menurut persamaan reaksi
berikut ini.
SIFAT FISIKA DAN KEGUNAAN ESTER
Ester yang
memiliki 3 sampai 5 atom karbon dapat larut dalam air dan selebihnya
tidak larut dalam air. Ester merupakan kelompok senyawa organik yang
memiliki aroma yang wangi seperti bunga dan buah sehingga banyak
digunakan sebagai pengharum (essence), sarirasa dalam industri makanan
dan minuman. Ester yang digunakan biasanya yang berwujud cair pada suhu
dan kamar.
Titik leleh dan
titik didih ester lebih rendah dibanding asam karboksilat dan alkohol
asamnya. Hal ini disebabkan dalam ester tidak terbentuk ikatan hidrogen
antarmolekulnya sedangkan pada alkohol dan asam karboksilat terjadi
ikatan hidrogen antarmolekulnya. Adanya ikatan hidrogen inilah yang
menyebabkan titik leleh dan titik didih alkohol asalnya lebih tinggi.
Kelompok ester yang memiliki aroma buah disajikan pada tabel berikut ini, (dikutib dari wikipedia.org).

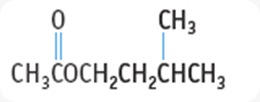
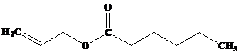
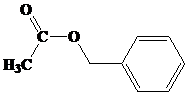
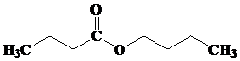
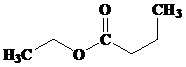
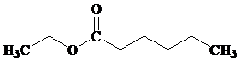


No comments:
Post a Comment